آرایش الکترونی که با نامهای پیکربندی الکترونی یا چینش الکترونی نیز شناخته میشود، یک مفهوم بنیادی در شیمی و فیزیک اتمی است. این مفهوم به چگونگی توزیع الکترونهای یک اتم یا مولکول در اوربیتالهای اتمی پیرامون هسته اشاره دارد. اساس آرایش الکترونی بر پایۀ اصول مکانیک کوانتومی استوار است که طبق آن، الکترونها در سطوح انرژی گسستهای به نام لایههای الکترونی (K, L, M و ...) و زیرلایههای مختلف (مانند s, p, d, f) قرار میگیرند. شناخت دقیق این آرایش، کلید درک رفتار اتمها و پیشبینی خواص شیمیایی آنها است.
الگوهای حاکم بر آن توسط اصول و قواعد مشخصی تعیین میشوند. مهمترین این اصول عبارتاند از اصل آفبا که ترتیب پر شدن اوربیتالها را از سطح انرژی پایینتر به بالاتر مشخص میکند، اصل طرد پائولی که مطابق آن حداکثر دو الکترون با اسپین مخالف میتوانند یک اوربیتال را اشغال کنند، و قاعدۀ هوند که بیان میدارد در اوربیتالهای همانرژی، الکترونها ترجیح میدهند تا حد امکان در اوربیتالهای جداگانه و با اسپین موازی قرار گیرند. این قوانین در کنار یکدیگر، الگویی منظم و قابل پیشبینی برای چینش الکترونها حول هسته ایجاد میکنند.
اهمیت مطالعۀ آرایش الکترونی در آن است که این آرایش، مستقیماً مسئول تعیین همۀ خواص شیمیایی و بسیاری از خواص فیزیکی یک عنصر است. برای نمونه، تعداد الکترونهای موجود در آخرین لایه، نحوۀ پیوند شیمیایی اتم با دیگر اتمها، انرژی یونش، الکترونگاتیوی، خاصیت فلزی یا نافلزی و رفتار مغناطیسی عنصر را مشخص میکند. در نتیجه، آرایش الکترونی نه تنها به عنوان شناسۀ منحصربهفرد هر عنصر عمل میکند، بلکه مبنای علمی برای توجیه تناوبی بودن خواص عناصر در جدول تناوبی مدرن به شمار میرود.
آرایش الکترونی
{electron configuration} [شیمی] توزیع الکترون ها بین اوربیتال های اتمی یک عنصر
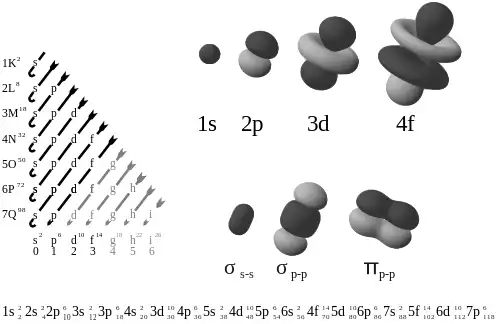
آرایش الکترونی. آرایش الکترونی ( به انگلیسی: Electron configuration ) نحوه چینش الکترون ها در اوربیتال ها اطراف هسته اتم را نشان می دهد؛ و شیوه پر شدن زیر لایه ها به ترتیب زیر است:
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s - 4f - 5d - 6p - 7s - 5f - 6d - 7p - 8s
در s حداکثر ۲ الکترون در p حداکثر ۶ الکترون در d حداکثر ۱۰ و در f حداکثر ۱۴ الکترون قرار می گیرد. به طور مثال آرایش الکترونی گالیوم که ۳۱ الکترون دارد به صورت زیر نوشته می شود:
۱s۲۲s۲۲p۶۳s۲۳p۶۴s۲۳d۱۰۴p۱
که البته به صورت مرتب شده و به شکل زیر نوشته می شود:
۱s۲۲s۲۲p۶۳s۲۳p۶۳d۱۰۴s۲۴p۱
نکته مهم: در آرایش الکترونی اتم خنثی هرگز زیرلایه d4 یا d9 نداریم دراین حالت باید از زیر لایه s کناری ۱ الکترون کم کرده وبه زیر لایه d می دهیم بر فرض مثال آرایش الکترونی عنصر مس ۲۹ بدینگونه می باشد: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 همان طور که می بینید بر اساس قاعده آفبا باید ان را مرتب کنیم: 1s2 2s2 2p6 3s2 3p6 3d9 4s2 براساس نکته بالا ما باید از زیر لایه sیک الکترون به d بدهیم و تمام که می شود: 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
اصل آفبا ( به آلمانی: Aufbau )، به معنی ساختن یکی از اصول آرایش الکترونی است که می گوید: ترتیب عناصر پرشدن لایهٔ الکترونی به صورت ۲ ( ۸ ( ۸ ( ۲ ( است و اگر الکترون باقی ماند آن را به لایهٔ سوم یعنی:۲ ( ۸+۸ ( ۸ ( ۲ ( پر می کنیم. ( لایهٔ سوم را تا سقف ۱۸ الکترون می توان پر کرد )
این اصل برای ۱۸ عنصر اول به خوبی صدق می کند. اما اصل مادلونگ که در سال ۱۹۳۶ و توسط آروین مادلونگ ارائه شد به خوبی تا ۱۰۰ عنصر اول صدق می کند
• Orbitals are filled in the order of increasing n+l;
• Where two orbitals have the same value of n+l, they are filled in order of increasing n.
از طریق این اصل ترتیب پرشدن اوربیتال ها بدین گونه است:
آرایشالکترونی
(شیمی): شیوه قرار گرفتن الکترونها در اطراف هسته اتم.
حوزه: [شیمی]: توزیع الکترونها بین اوربیتالهای اتمی یک عنصر.