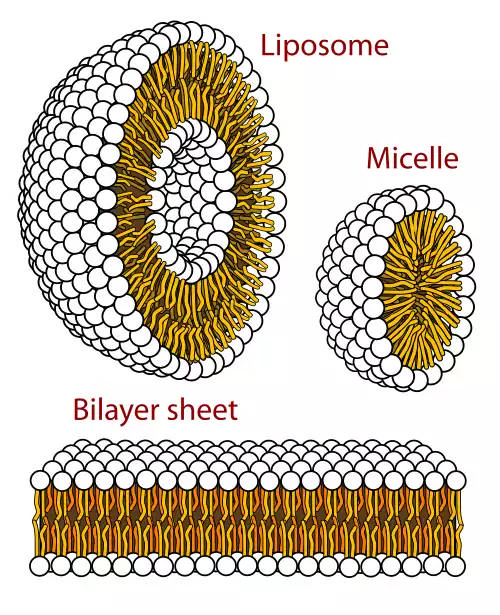
میسل (Micelle) به تجمعاتی از مولکولهای سورفکتانت در محلولهای آبی اطلاق میشود که در غلظتهای بالاتر از یک حد بحرانی به نام غلظت بحرانی ميسلسازی (CMC) تشکیل میشوند. در این ساختارها، قسمتهای آبدوست (هیدروفیلیک) مولکولها به سمت بیرون و قسمتهای آبگریز (هیدروفوبیک) به سمت داخل میروند و بدین ترتیب یک هسته مرکزی آبگریز و یک سطح بیرونی آبدوست ایجاد میشود.
این ساختارهای مولکولی در صنایع مختلفی مانند شویندهها، دارورسانی، گوارش و امولسیونسازی کاربرد دارند. در شویندهها، میسلها با احاطه کردن ذرات چربی و آلودگیها در هسته خود، آنها را در محیط آبی حل کرده و به پاکسازی کمک میکنند. در دارورسانی، میسلها میتوانند داروهای هیدروفوبیک را در هسته خود حل کرده و به سلولهای هدف منتقل کنند.
فرآیند تشکیل آنها به نام ميسلاسیون شناخته میشود که در آن، مولکولهای سورفکتانت با ویژگی آمفیفیلیک (دارای قسمتهای آبدوست و آبگریز) به صورت خودجوش در محلول تجمع میکنند. شکل و اندازه میسلها میتواند بسته به نوع سورفکتانت، دما و شرایط محیطی متفاوت باشد.
میسل. [ س ِ ] ( فرانسوی، اِ ) ( اصطلاح گیاه شناسی ) ملکولهای به هم پیوسته چندی که ساختمان پروتیدها یا مواد سفیده مانند را تشکیل می دهند. ( از گیاه شناسی گل گلاب ص 7 و 10 ). رجوع به گیاهشناسی ثابتی ص 38 و 76 شود.
ملکولهای به هم پیوسته چندی که ساختمان پروتیدها یا مواد سفیده مانند را تشکیل می دهند
میسل ( به انگلیسی: Micelle ) گروهی از مواد فعال سطحی متراکم هستند که در یک کلویید مایع پراکنده اند. سورفکتانت ها مولکول های آلی و دارای ویژگی دوگانه آبدوستی و آبگریزی می باشند. در غلظت های کم، مولکول های سورفکتانت به صورت مونومر در محلول وجود دارند. اما با افزایش غلظت و رسیدن به یک نقطه بحرانی این مونومرها به هم نزدیک شده و تجمع هایی به نام میسل به وجود می آورند. در یک محلول آبی، یک ریزلقمهٔ معمول، مناطق متراکم با سرِ آب دوست، دارای تماس با محیط حلال را شکل می دهد، و با مناطق تک دُمِ آب گریز در مرکز ریزلقمه فاصله می اندازد. علت این پدیده رفتار فازی دولایهٔ لیپید در تک دم لیپیدها است. میسل ها اشکال مختلفی دارند مثل کره واستوانه وصفحه ای. این که یک میسل چرا کروی ویاچرا استوانه ای است و… بستگی به شرایط محیط و نوع ماده فعال سطحی بستگی دارد.
در سال ۱۹۱۳، در دانشگاه بریستول، جیمز ویلیام مک برین، فرضیه ی وجود یون کلوییدی را برای تشریح هدایتِ الکترولیتی سدیم پالمیتات مطرح نمود. این فرضیه به شکل دادن خوشه هایی انجامید که امروزه ریزلقمه نامیده می شوند.
برهم کنش های آب گریزی یکی از برهم کنش هایی است که بین اجزای حلال و حل شونده اتفاق می افتد. این برهم کنش باعث تشکیل ساختارهای تجمعی از حل شونده ها در یک حلال نامتجانس می شود. مولکول های یک حلال ( به ویژه آب ) معمولاً تمایل زیادی به یکدیگر دارند. تنها حل شونده هایی در محیط آبی حل می شوند که بتوانند بر نیروی جاذبه بین مولکول های آب غلبه کنند و در غیر این صورت، آب آن ها را به درون ساختار خود راه نمی دهد و از پخش شدن آن ها جلوگیری می کند و بنابراین ساختارهای تجمعی تشکیل می شوند. ساختار میسلی یکی از این ساختارهای تجمعی است که هنگام افزودن مولکول های فعال سطحی به حلال های آبی ایجاد می شود. مولکول های فعال سطحی، مولکول هایی دوگانه دوست بوده و دارای یک بخش آب دوست و یک بخش آب گریز هستند. هنگامی که مولکول های فعال سطحی در محیط آبی حل می شود، بخش های آب دوست به سمت آب متمایل بوده و انتهای آب گریز آن ها به شدت توسط مولکول های آب پس زده می شود؛ لذا با افزودن مقادیر مناسبی از مولکول های فعال سطحی به حلال های آبی، تجمع های مولکولی تشکیل می شود. در این تجمع های مولکولی، سر آب دوست به سمت بیرون ( محیط آبی ) متمایل بوده و انتهای آب گریز مولکول ها به سمت یکدیگر قرار می گیرند. چنین ساختاری یک میسل متعارف نامیده می شود. حال چنانچه این مولکول های فعال سطحی به یک حلال آلی اضافه شوند، به دلیل قطبیت نه چندان بالای حلال، انتهای آب گریز به سمت حلال جهت گیری کرده و سرهای آب دوست در کنار یکدیگر جمع می شوند. به چنین ساختاری که در حلال های آلی مشاهده می شود، ساختار میسل معکوس گفته می شود. در میسل معکوس بر خلاف میسل متعارف، مولکول های فعال سطحی کره های آب را که در حجمی از روغن قرار دارند، می پوشاند.
میسل (شهر). مسل ( به آلمانی: Messel ) یک شهر در آلمان است که در دارمشتات - دیبورگ واقع شده است. مسل ۳٬۹۲۸ نفر جمعیت دارد.